O congresso de Medicina Interna do American College of Physicians (ACP 2024) continua trazendo temas interessantes para os clínicos e intensivistas. Na palestra do Dr. Michael Connor, do departamento de Medicina Intensiva e Nefrologia da Universidade de Emory, tivemos a oportunidade de desfazer alguns mitos e organizar o pensamento sobre o manejo da injúria renal aguda (IRA) entre os pacientes hospitalizados.
IRA em pacientes hospitalizados
A prevalência da IRA durante a internação é de aproximadamente 20%, migrando para quase 60% entre os doentes críticos. No primeiro cenário, predominam os casos leves (80%); já na terapia intensiva, quase um terço dos casos são graves, com demanda por terapia renal substitutiva (TRS) em 13,5%.
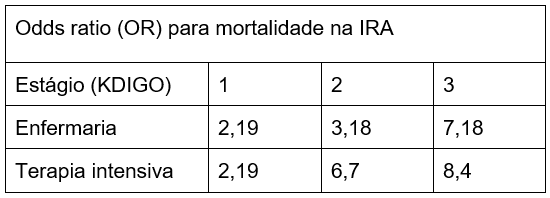
A IRA impacta diretamente sobre a mortalidade hospitalar, conforme expresso na tabela abaixo:
Os fatores de risco modificáveis para IRA merecem destaques, pois sobre eles intervenções podem ser tomadas.

A classificação da IRA contempla as seguintes categorias: mediada por perfusão (termo preferível ao clássico pré-renal), intrarrenal, pós-renal ou mista. O raciocínio médico será mais bem compartimentalizado, entretanto, se forem considerados os três principais mecanismos fisiopatológicos: alterações hemodinâmicas, nefrotoxicidade e inflamação.
As causas mais comuns de IRA são a sepse (41%) e as doenças cardiovasculares (19,2%).
Nesse aspecto, uma causa, por muitas vezes iatrogênica, de IRA merece destaque: a sobrecarga volêmica. Muitos de nós nos preocupamos, ao iniciar antibióticos reconhecidamente nefrotóxicos, como a vancomicina, amicacina ou polimixina. Entretanto, ainda há muita negligência sobre o uso indiscriminado de cristaloides e expansores plasmáticos. A congestão venosa sistêmica promove o aumento da pressão intracompartimental renal, limitando a sua perfusão. Dessa forma, otimizar a volemia do paciente com IRA não significa maximizá-la. A hidratação venosa, ao contrário do que se imagina, tem o potencial de prejudicar a evolução desses pacientes. Em contrapartida, a busca pelo balanço hídrico negativo e a diureticoterapia pode ser comportar como medidas de nefroproteção, como é o caso dos pacientes com insuficiência cardíaca que estão em processo de descongestão.
A abordagem mais racional de fluidos deve levar em conta a predição do status volêmico, algo que traz desafios e grande variação de condutas entre os colegas médicos.
Nesse quesito, busca-se o aperfeiçoamento multiparamétrico da informação, valendo-se do exame físico (hidratação de mucosas, turgor da pele), monitorização do débito urinário e dados hemodinâmicos, ultrassonografia à beira do leito (protocolo VEXUS, ultrassonografia pulmonar e, com as devidas ressalvas, a avaliação da veia cava inferior) ou monitorização invasiva com análise do débito cardíaco por meio dos cateteres centrais ou linhas arteriais.
Definição e diagnóstico
A definição atual da IRA é pautada nos critérios do KDIGO, ancorando-se na dosagem de creatinina sérica e na monitorização do débito urinário. Faz-se necessária uma piora súbita e rápida da função renal, em um período menor ou igual a 7 dias, conforme demonstrado abaixo:

A partir do momento em que há disfunção renal persistente, por mais do que sete dias, passamos a nos referir à doença renal aguda (7-90 dias) e à doença renal crônica (DRC) quando ultrapassar a marca dos 90 dias.
A abordagem diagnóstica básica inclui a dosagem de creatinina, monitorização do débito urinário e exame simples de urina (EAS).
A principal vantagem da creatinina é a sua grande disponibilidade. Entre suas limitações, inclui-se o fato de ser um marcador tardio e de limitada sensibilidade, especialmente entre idosos e sarcopênicos. A cistatina C, menos disponível, ainda não foi estudada com maior robustez no cenário da IRA, embora seja uma ferramenta promissora. Um detalhe importante é que as várias fórmulas preditivas da taxa de filtração glomerular (TFGe), como o CKD-EPI e MDRD, não foram validadas para a IRA, motivo pelo qual não são aplicáveis a esse contexto.
E o débito urinário, agrega algo no diagnóstico e na predição de prognóstico? A resposta a essa pergunta fica bem clara quando analisamos os dados abaixo.
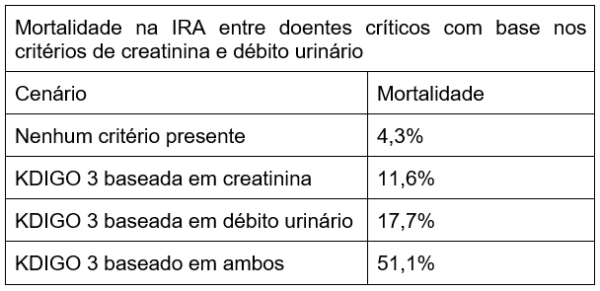
O débito urinário é, portanto, uma ferramenta útil no diagnóstico da IRA, predizendo a complicação de forma um pouco menos atrasada do que a creatinina, sendo de fácil realização. Um argumento contrário a sua adoção universal é a necessidade de manter o cateterismo vesical de demora, uma fonte de infecção e promotora de imobilidade e delirium.
Um estudo demonstrou que, em centros de terapia intensiva (CTI), a monitorização sistemática do débito urinário se associou a menor balanço hídrico acumulado, especialmente na faixa maior ou igual a 10% em 72h: 2,97% vs. 7,13% no grupo em que o débito urinário não foi monitorado.
O EAS é essencial e permite identificar cilindros, piócitos, hemácias, cristais, glicosúria e proteinúria. A relação albumina-creatinina urinária (UA/UC) é recomendada, sendo um substituto acurado da proteinúria de 24 horas. O sódio urinário, a fração de excreção de sódio e ureia, amplamente utilizados, têm valor diagnóstico limitado e devem ser aplicados exclusivamente aos pacientes oligúricos.
As maiores expectativas estão centradas nos biomarcadores, ainda indisponíveis de forma ampla na prática cotidiana, inclusive nos EUA. A principal aplicabilidade é identificar precocemente a lesão renal e viabilizar a rápida adoção das medidas de nefroproteção recomendadas pelo KDIGO. Os mais conhecidos são o Kim-1 e NGAL, mas não são os mais promissores.
A combinação de biomarcadores com a melhor área sob a curva (AUC) de predição de IRA KDIGO 2 e 3, aproximando-se dos 80%, se dá com o TIMP-2 e o IGFBP7. Tratam-se de moléculas exclusivamente renais, que começam a ser excretadas na urina tão logo os túbulos param de se replicar em situações de estresse. Os estudos BigPAK e PrevAKI, realizados em 2018 e 2017, respectivamente, demonstraram que o uso dos biomarcadores permite selecionar pacientes para a adoção de medidas protetivas sistemáticas, reduzindo a frequência de evolução para IRA.
O teste de estresse com furosemida, que traz muitas controvérsias, é um preditor excelente da gravidade da IRA (AUC 87%). Ele não deve ser aplicado, contudo, diante de óbvia hipovolemia e desidratação, sob pena de agravar a má perfusão renal.
O teste é realizado com 1 mg/kg (entre os virgens de diurético de alça) ou 1,5 mg/kg (entre os experimentados), sendo a resposta positiva se o débito urinário em 2 horas for maior ou igual a 200 mL. Para contextualizar, a sua capacidade preditiva supera a dos biomarcadores NGAL e KIM-1.
A adoção dos biomarcadores traz consigo uma nova entidade, que seria a IRA “subclínica”, quando há a positividade dos biomarcadores, na ausência de elevação da creatinina ou alteração do débito urinário.
A IRA passa a ser definida, então, como estrutural (alteração exclusiva de biomarcadores); funcional (alteração exclusiva da creatinina e/ou débito urinário); e estabelecida (alteração de ambos componentes).
A IRA estrutural ou “subclínica” está associada a eventos hospitalares significativos, como necessidade de TRS, tempo de permanência em CTI e enfermaria e a composição entre TRS e morte (15,5% vs. 4,9% na ausência de alteração dos biomarcadores).
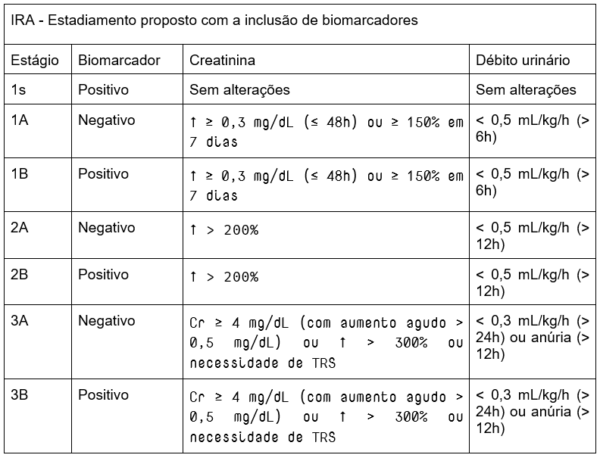
Um novo estadiamento da DRC, portanto, foi proposto em 2020, levando-se em conta o importante papel dos biomarcadores:
A ultrassonografia de rins e vias urinárias, frequentemente solicitada na IRA, é útil quando há suspeita de obstrução do trato urinário ou quando há a necessidade de diferenciar DRC e IRA com base nos critérios morfológicos. De toda forma, a sua solicitação universal é incapaz de trazer mudanças de conduta na maioria dos casos, concluindo-se que há um exagero nessa propedêutica.
Tratamento
O tratamento da IRA é baseado em algumas etapas:

Mais uma vez retomamos a questão dos diuréticos. Muito raramente a furosemida e os tiazídicos são causas de nefrite intersticial alérgica. Nesse quesito, citamos o compartilhamento do grupo sulfonamida entre os tiazídicos e as sulfas, o que pode mediar eventos imunomediados.
Nos pacientes internados, quando há a indicação de iniciar diuréticos para manter a hemostasia volêmica, em geral estamos lidando com uma performance renal já diminuída e capacidade limitada de excretar sal e água. Portanto, o aumento de creatinina provavelmente ocorrerá a despeito da diureticoterapia, sinalizando que o prejuízo funcional e o insulto inicial continuam presentes. O compilado de vários estudos aponta, em sua maioria, que o emprego da furosemida não aumentar a mortalidade entre doentes críticos, sendo uma ferramenta útil para minimizar uma das complicações da IRA: a hipervolemia.
Em relação às nefrotoxinas, sempre pensar em alternativas seguras do ponto de vista renal e questionar se os fármacos são essenciais e se a duração da exposição pode ser limitada.
A TRS é indicada para o tratamento das complicações da IRA. Vários estudos buscaram definir o melhor momento para instituí-la: pré-emptiva (quando indicada por piora dos parâmetros renais e surgimento de complicações)? Padrão (por ocasião da instalação da urgência dialítica)? Atrasada (diante do surgimento de emergência dialítica)?
Entre os estudos os mais proeminentes são o AKIKI, AKIKI2, IDEAL-ICU, STARRT-AKI e ELAIN. Apesar de alguns pontos conflitantes, no geral chegamos à conclusão de que a diálise atrasada implica em maior mortalidade (68%), embora permita selecionar um subgrupo que se recupera e dispensa a TRS. Esse subgrupo específico apresenta menor mortalidade: 26%.
O benefício da TRS tende a diminuir com a implementação tardia, e pode se configurar como uma medida fútil quando já instaladas múltiplas disfunções orgânicas. Por outro lado, a TRS precoce ou pré-emptiva é danosa, impedindo que muitos pacientes se recuperem espontaneamente e submetendo os indivíduos aos riscos do procedimento.
A alta hospitalar segura pode ser realizada com a suspensão das nefrotoxinas (incluindo IBPs e AINEs), resolução do insulto primário, presença de perfusão renal adequada e ausência de sobrecarga volêmica.
O débito urinário deve estar adequado, geralmente com pelo menos 1L/dia, e a creatinina e ureia devem estar em queda ou ter alcançado um platô consistente. Os distúrbios eletrolíticos e ácidos básicos devem estar corrigidos e o risco de diálise de urgência deve ser considerado muito baixo.
O momento da alta é também o de planejamento do seguimento ambulatorial. Principalmente nos casos de IRA KDIGO 2 ou 3, recomenda-se a avaliação sequencial por nefrologista. A mensuração da creatinina, bem como avaliação do EAS e relação UA/UC em 3 meses fornecem importantes informações prognósticas. Lembramos que esses pacientes estão sob risco aumentado de DRC em até 8 vezes e de DRC terminal em 3 vezes. O risco de insuficiência cardíaca e mortalidade também encontra-se aumentado. Apesar de todas essas questões, menos de 15% desses pacientes de fato realizam o seguimento pós-alta hospitalar.
Mensagens práticas
- A IRA é muito prevalente entre pacientes internados, especialmente em terapia intensiva.
- As principais causas são a sepse e as doenças cardiovasculares.
- A sobrecarga volêmica é deletéria e impede a adequada perfusão renal. Otimizar o status volêmico não significa maximizá-lo e, em alguns casos, envolve a promoção de balanço hídrico negativo por meio da diureticoterapia, como é o caso na IC descompensada em processo de descongestão.
- A creatinina, mensuração do débito urinário, exame simples de urina e a relação proteína-creatinina urinária são as propedêuticas mais disponíveis.
- Os biomarcadores são promissores e permitem contornar o atraso diagnóstico esperado quando nos embasamos exclusivamente nos parâmetros clássicos.
- O manejo da IRA envolve a otimização do status volêmico, evitação de nefrotoxinas, ajustes posológicos dos fármacos administrados e correção das condições de base.
- A terapia renal substitutiva é válida quando as complicações da IRA (hipervolemia, hipercalemia e acidose metabólica) estão presentes e não podem mais ser contornadas com outras medidas. Não há benefício da diálise pré-emptiva e nem da atrasada, trazendo ambas impactos negativos sobre a mortalidade.
- Os pacientes que experimentaram IRA têm risco aumentado para DRC e DRC terminal, de forma que o seguimento pós-alta, prioritariamente por nefrologistas nos estágios KDIGO 2 e 3, é fundamental, embora extremamente negligenciado.
Continue acompanhando o congresso do ACP com a gente! Veja outros destaques:
- Dicas sobre MASLD para o clínico
- Revisando os principais estudos de endocrinologia de 2023
- Discussão sobre a síndrome coronariana aguda
Autoria

Leandro Lima
Editor de Clínica Médica da Afya ⦁ Residência em Clínica Médica (2016) e Gastroenterologia (2018) pelo Hospital das Clínicas da Universidade Federal de Minas Gerais (HC-UFMG) ⦁ Residência em Endoscopia digestiva pelo HU-UFJF (2019) ⦁ Preceptor do Serviço de Medicina Interna do HU-UFJF (2019) ⦁ Graduação em Medicina pela Universidade Federal de Juiz de Fora (UFJF)
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.

