Foi aprovado pela Agência Nacional de Vigilância Sanitária (Anvisa) o registro acelerado do medicamento ustequinumabe (STELARA®) para o tratamento da psoríase em placas moderada à grave em pacientes pediátricos de 6 a 17 anos, que não responderam, que têm uma contraindicação ou que são intolerantes a outras terapias sistêmicas.
Além disso, é indicado para o tratamento de adultos com artrite psoriásica ativa e para pacientes em fases moderada à grave da Doença de Crohn e da retocolite ulcerativa.
O Brasil é o primeiro país a aprovar o uso de ustequinumabe para a faixa etária de 6 a 11 anos. Entre os mais de 3 milhões de brasileiros convivendo com a psoríase, estima-se que um terço começa a apresentar manifestações da enfermidade antes da idade adulta.
“Em crianças e adolescentes, a doença pode ter um impacto profundamente negativo afetando a imagem pessoal, a autoestima e, consequentemente, as relações familiares e sociais, tão importantes nessa época da vida”, destaca o Ricardo Romiti, diretor da Unidade de Psoríase do Departamento de Dermatologia do Hospital das Clínicas e professor da Universidade de São Paulo.
Segundo o médico, a substância age bloqueando de forma específica a reação inflamatória, tendo como alvo as citocinas, moléculas que promovem a reação inflamatória causadora das descamações e placas na pele.
A terapia representa uma inovação no manejo da psoríase nessa faixa etária e uma alternativa aos corticoesteroides.
O principal risco relacionado ao seu uso é o surgimento de infecções. As reações adversas mais comuns identificadas com o uso do medicamento são nasofaringite e cefaleia.
Leia também: Whitebook: saiba o que é psoríase e como identificar
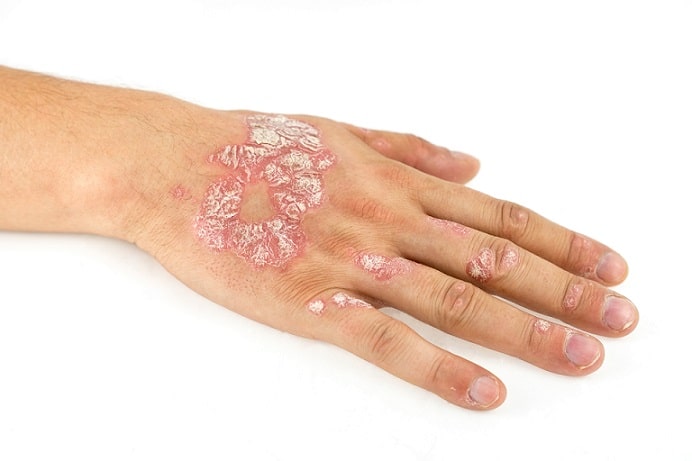
Psoríase
Este é o primeiro tratamento biológico aprovado para essa população de pacientes que bloqueia seletivamente as interleucinas (IL)-23/IL-12, importante alvo terapêutico no combate à psoríase.
“Essa aprovação é um marco importante para as crianças e os adolescentes que lutam diariamente para lidar com os sinais e os sintomas da psoríase, além das famílias que tanto buscavam uma opção de tratamento segura e efetiva para seus filhos”, afirma Lloyd Miller, vice-presidente e líder da área de doenças imunodermatológicas da Janssen Research & Development, LLC.
Essa aprovação foi baseada em dois estudos multicêntricos de fase III, CADMUS (12-17 anos) e CADMUS Jr. (6-11 anos), que avaliaram a eficácia e a segurança do medicamento.
Uma melhora de 90% das lesões na pele causadas pela psoríase foi demonstrada em 64% dos pacientes de até 11 anos e em 61% dos pacientes de 12 a 17 anos tratados com ustequinumabe por 12 semanas. As respostas aumentaram para 71% e 66%, respectivamente, depois de 52 semanas de tratamento. Os pacientes que usaram o remédio tiveram uma melhora significativa do seu quadro clínico e da qualidade de vida.
Os dados de segurança dos estudos foram consistentes com os perfis de segurança conhecidos, descritos nas respectivas bulas atuais, sendo que o ustequinumabe foi geralmente bem tolerado por pacientes pediátricos com psoríase em placas.
Em geral, os eventos adversos e outros dados de segurança reportados por até um ano em ambos os estudos foram similares aqueles em adultos com psoríase em placa.
A Janssen também recebeu parecer positivo do Comitê de Medicamentos para Uso Humano (CHMP) da Agência Europeia de Medicamentos (EMA) em 12 de dezembro de 2019 recomendando a autorização da comercialização de ustequinumabe na União Europeia para o tratamento da psoríase em placas moderada à grave em pacientes pediátricos de 6 a 11 anos.
Nos Estados Unidos, a Janssen anunciou que fez a mesma submissão no Food and Drug Administration (FDA) em outubro de 2019, e a revisão do órgão regulador está em processo.
*Esse artigo foi revisado pela equipe médica da PEBMED
Referências bibliográficas:
- https://clinicaltrials.gov/ct2/show/NCT02698475
- http://www.janssen.com/brasil/sites/www_janssen_com_brazil/files/prod_files/live/stelara_pub_vp.pdf
Autoria

Úrsula Neves
Jornalista formada pela Universidade Estácio de Sá (UNESA), pós-graduada em Comunicação com o Mercado pela Escola Superior de Propaganda e Marketing (ESPM) e em Gestão Estratégica da Comunicação pelo Instituto de Gestão e Comunicação (IGEC/FACHA)
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.

