Historicamente, o tratamento da esclerose múltipla (EM) buscava a melhora clínica do paciente em termos de:1,2
- aumento da capacidade funcional
- redução das comorbidades
- atenuação dos sintomas da doença
Com a ampliação das opções de drogas modificadoras do curso da doença (DMDs), os objetivos terapêuticos estão evoluindo para uma abordagem do tipo “tratamento por metas” (treat to target) e passaram a incluir:3,4
- ausência de surtos clínicos da doença
- ausência de progressão da incapacidade
- ausência de lesões novas ou aumentadas no exame de ressonância magnética nuclear (RMN)
Embora o desfecho NEDA (sem evidências de atividade da doença, do original No Evidence of Disease Activity) inicialmente não fosse atingível para a maioria dos pacientes com EM, uma atitude complacente no manejo da condição foi se tornando cada vez menos aceitável.3,4
Glicocorticoides são utilizados para tratar os surtos e mostram benefício clínico no curto prazo, ao reduzir a intensidade e a duração dos episódios agudos.1,2
Drogas modificadoras do curso da doença (DMDs) visam reduzir as células imunogênicas circulantes, suprimir a adesão dessas células ao epitélio e, consequentemente, reduzir sua migração para o parênquima e a resposta inflamatória decorrente. Não são recomendadas associações de DMDs no manejo da esclerose múltipla (EM).1,2
Drogas Modificadoras do curso da Doença (DMDs)
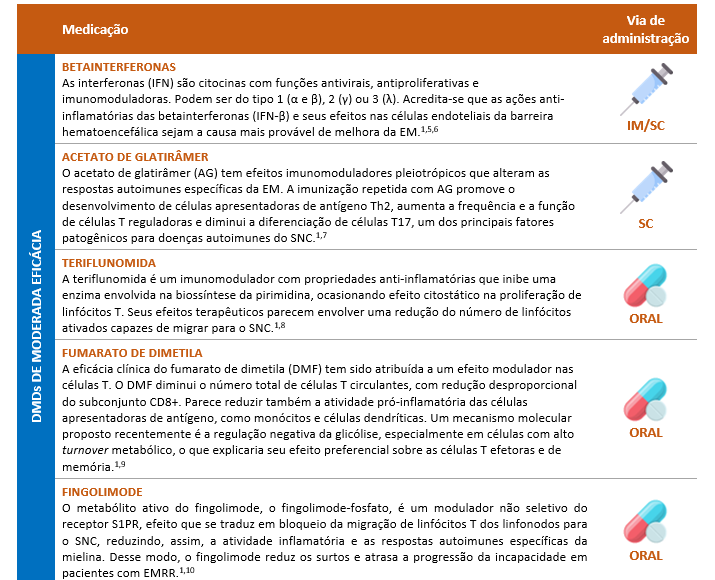

A azatioprina, medicação de uso oral usada no tratamento de primeira linha da EM, é considerada uma opção menos eficaz e só deve ser utilizada em casos de pouca adesão às terapias parenterais.1
Mecanismos de ação das DMDs
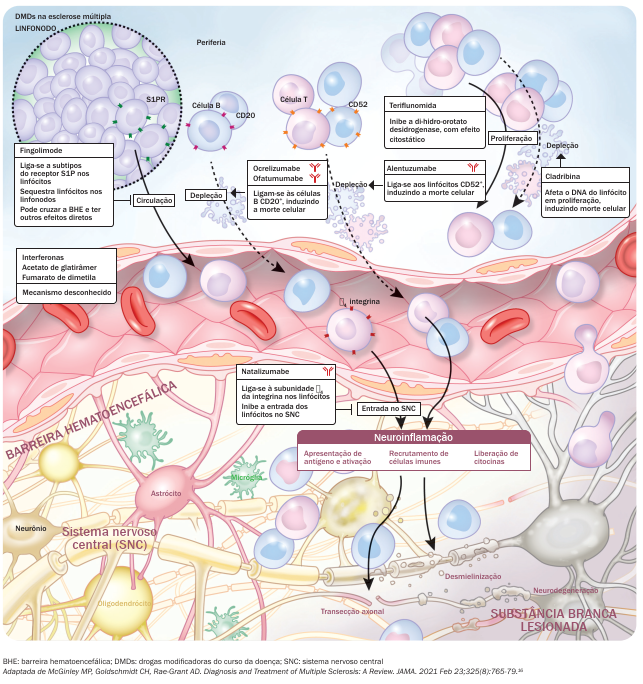
Adaptada de McGinley MP, Goldschmidt CH, Rae-Grant AD. Diagnosis and Treatment of Multiple Sclerosis: A Review. JAMA. 2021 Feb 23;325(8):765-79.16
Linhas de tratamento da Esclerose Múltipla Remitente-Recorrente (EMRR) com DMDs no sistema público de saúde
Diversas DMDs têm sido desenvolvidas e aprovadas para pacientes com EMRR e síndrome clinicamente isolada (CIS, do original em inglês clinically isolated syndrome). Em geral, essas terapias atuam na neuroinflamação e podem ter efeito indireto na neurodegeneração.2 No âmbito do Sistema Único de Saúde (SUS), o PCDT da EM1 propõe um algoritmo para uso das DMDs em pacientes com EM de baixa/moderada ou alta atividade.1 (Figura 1)
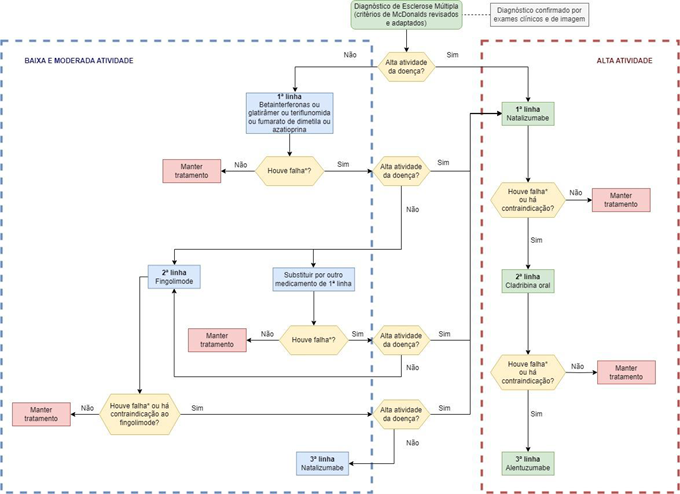
EM: esclerose múltipla; DMDs: drogas modificadoras do curso da doença.
Adaptada de: Brasil. Ministério da Saúde. Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde. Protocolo Clínico e Diretrizes Terapêuticas (PCDT) da Esclerose Múltipla. 2024.1
Linhas de tratamento da EMRR com DMDs no sistema privado de saúde12
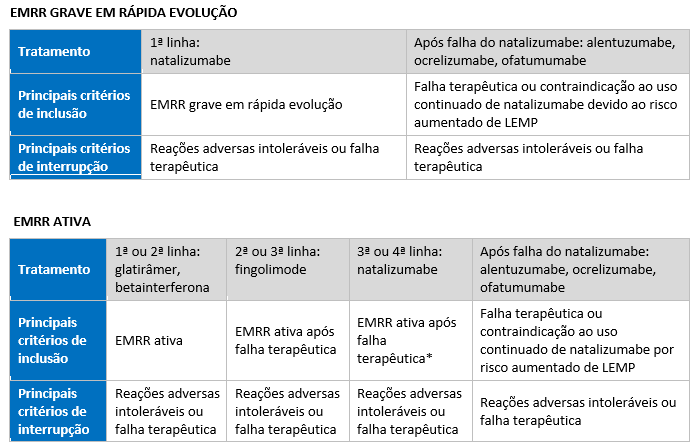
EMRR grave em rápida evolução definida por ≥2 surtos incapacitantes em 1 ano, com ≥1 lesão realçada por gadolínio, ou aumento significativo das lesões em T2, em comparação com ressonância magnética nuclear (RMN) anterior recente.
Reações adversas intoleráveis após considerar todas as medidas atenuantes.
Falha terapêutica definida por ≥2 surtos moderados ou graves (com sequelas ou limitações significantes e pouco responsivas à pulsoterapia) em 12 meses ou aumento de 1 ponto na Escala Expandida do Estado de Incapacidade (EDSS, do original Expanded Disability Status Scale) ou progressão significativa de lesões em atividade na doença.
Risco aumentado de LEMP definido pela presença de todos os fatores de risco descritos a seguir: resultado positivo para anticorpo anti-JCV (vírus John Cunningham), mais de 2 anos de tratamento com natalizumabe e terapia prévia com imunossupressor.
O uso precoce das Terapias de Alta Eficácia para a EM
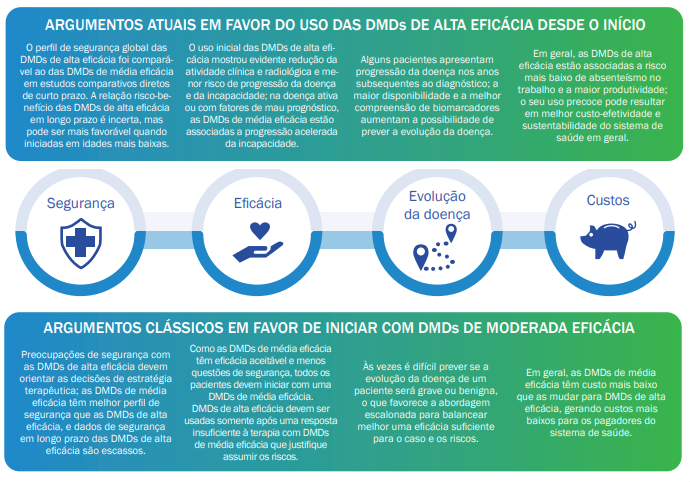
Em artigo publicado em 2020, Stankiewicz e Wigner argumentam que a possibilidade de prever a evolução da EM é pouco confiável no início do curso da EM, que o acompanhamento com exames de imagem pode subestimar os danos neuronais contínuos em pacientes subtratados e que a EM não é uma doença benigna no longo prazo, com impacto funcional muitas vezes subvalorizado. Tais preocupações, juntamente com a disponibilidade recente de agentes mais eficazes e seguros, sugerem que iniciar tratamentos de maior eficácia precocemente é a melhor maneira de atingir os melhores resultados possíveis em longo prazo para pacientes com EM.17 Tais argumentos são reforçados em outro artigo, publicado em 2024 por Oreja-Guevara et al.18 (Figura 2)
Importante considerar alguns fatores demográficos, clínicos e radiológicos que preveem um pior curso clínico e um resultado ruim a longo prazo. No entanto, os fatores mais importantes neste contexto são a presença de doença altamente ativa (por exemplo, recidivas frequentes e novas lesões de ressonância magnética), envolvimento radiológico extenso de lesões desmielinizantes (como, lesões multifocais, alto número de lesões; e alta carga T2 da doença), envolvimento da medula espinhal e/ou recuperação incompleta da recidiva. Pacientes com essas características podem ser bons candidatos para iniciar o tratamento com DMT alta eficácia.19
Quando se fala em iniciar o tratamento precoce, a tomada de decisão compartilhada incorpora os valores e preferências do paciente nas decisões médicas e coloca o paciente no centro do atendimento. Os seus valores e preferências incluem opiniões individuais sobre eficácia, segurança, tolerabilidade (com o objetivo de minimizar riscos e efeitos colaterais) e conveniência do medicamento, disposição para aplicar injeções, prontidão para iniciar o DMD, urgência para iniciar o DMD e probabilidade de adesão.20
O paciente e a equipe médica devem considerar conjuntamente a decisão de iniciar uma DMD e selecionar a melhor opção, avaliando as evidências, benefícios, riscos e encargos disponíveis. Aspectos importantes incluem a educação do paciente sobre a história natural da doença, os fatores prognósticos do paciente, as categorias de DMD e fatores diferenciadores, as metas do tratamento e os resultados esperados. Auxílios à decisão, como texto, material audiovisual e mídia interativa, sobre EM e o papel das medicações também podem ser úteis.20
A doença atinge preferencialmente mulheres em idade fértil, com potencial para engravidar durante a maior parte da fase de surto-remissão da doença. Elas podem desejar não iniciar DMDs que sejam teratogênicos confirmados ou possíveis (por exemplo, teriflunomida, cladribina e fingolimode) ou que possam estar associados a maior risco de rebote na descontinuação (natalizumabe e fiոgοlimоde) se estiverem planejando engravidar em breve ou não estiverem dispostas a usar estratégias contraceptivas altamente eficazes. Outras DMDs têm riscos incertos durante a gravidez e a amamentação.21
Argumentos atuais em favor da Terapia de Alta Eficácia
Tempo do intervalo sem medicação (washout) para troca entre DMDs
A Sociedade Francesa de EM propõe os seguintes períodos de washout para troca entre as DMDs, visando prevenir eventos adversos por efeitos cumulativos:

Clique aqui e descubra como Biogen Linc pode transformar sua rotina clínica.
Autoria

Felipe Resende Nobrega
Editor médico de Neurologia da Afya • Residência Médica em Neurologia (UNIRIO) • Mestre em Neurologia (UNIRIO) • Graduação em Medicina pela Universidade Estácio de Sá
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.



