As encefalites autoimunes (EA) compreendem um grupo de doenças inflamatórias imunomediadas do parênquima cerebral. Frequentemente envolvem a substância cinzenta profunda ou cortical, com ou sem envolvimento da substância branca, meninges ou medula espinhal.
Atualmente estudos epidemiológicos sugerem que a encefalites autoimunes é tão comum quanto a encefalite infecciosa, com uma prevalência estimada de 13,7/100.000 pessoas ao ano. O rápido avanço do conhecimento sobre novos anticorpos e suas síndromes associadas criou o campo crescente da neuroimunologia. Neste texto, falaremos um pouco sobre o quadro clínico, propedêutica diagnóstica e diagnóstico diferencial de acordo com a síndrome clínica anatômica, exames solicitados e tratamento agudo.
Quando suspeitar de encefalite autoimune?
História e exame físico detalhados são o primeiro passo no diagnóstico de encefalites autoimunes. A apresentação clínica tem caráter agudo ou subagudo, com duração inferior a 3 meses. Apresentações para além desse período são vistas apenas em algumas dessas condições, especialmente para encefalites LGI1, CASPR2, DPPX e GAD65. Nessa situação, deve-se suspeitar de outras etiologias, como doenças neurodegenerativas.
Um curso monofásico é mais comum na encefalites autoimunes por anticorpos de superfície. Curso progressivo pode ser visto em encefalites paraneoplásicas, especialmente na degeneração cerebelar paraneoplásica (anti-Yo), que tende a se estabilizar após o tratamento do câncer. Já um curso recorrente-remitente fala a favor de doenças imunomediadas e desmielinizantes, como esclerose múltipla ou neuromielite óptica (anti-Aquaporina-4), porém a recorrência de surtos são raros nas encefalites autoimunes.
Uma infecção viral precedente (ex: resfriado comum ou diarreia) e/ou febre são comuns. Ainda, EA pode ser desencadeada por encefalite por vírus Herpes Simples (HSV) ou certas terapias imunomoduladoras, como inibidores de TNFα.
Importante: a reação imune na EA é geralmente difusa, resultando em inflamação cerebral multifocal e, ocasionalmente, dano adicional às meninges, medula espinhal e/ou sistema nervoso periférico. Assim, os sintomas variam de acordo com a localização anatômica da inflamação e existem várias categorias de síndromes clínico anatômicas, como as listadas na tabela abaixo (figura 1). Alguns anticorpos são associados a sintomas estereotipados, tais como discinesia oromandibular, alterações cognitivo/comportamentais, de fala, e disfunção autonômica na encefalite com anticorpo NMDAR; e convulsões distônicas fasciobraquiais (FBDS) na encefalite com anticorpo LGI1. No entanto, há uma sobreposição significativa de sintomas entre todos os anticorpos e formas de EA.
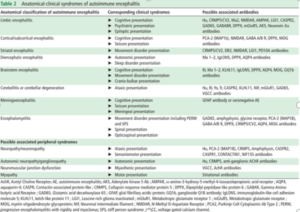
Vale ressaltar que pacientes oncológicos ou com risco aumentado de câncer (tabagistas, idosos, ou pacientes com perda de peso não intencional rápida) são propensos a EA paraneoplásica. Por outro lado, pacientes com histórico pessoal ou familiar de doenças autoimunes possuem risco aumentado de EA por anticorpos de superfície.
Quais investigações devem ser solicitadas quando há suspeita de EA?
Após a suspeita clínica de EA, uma avaliação detalhada é necessária para confirmar o diagnóstico e excluir possibilidades concorrentes, como encefalite infecciosa ou causas sistêmicas/metabólicas. Na maioria dos casos, a investigação começa com ressonância magnética do cérebro (RM) e análise do líquido cefalorraquidiano (LCR). O algoritmo de diagnóstico segue a estrutura resumida na figura detalhada abaixo:

- Neuroimagem
Além de descartar diagnósticos alternativos, a RM do cérebro com contraste pode mostrar alterações consistentes com uma ou mais das síndromes anatômicas das EA (figura 1). De acordo com os critérios clínicos de EA, definidos por Graus et al (2016), a presença de encefalite límbica bilateral é o único achado de ressonância magnética isolado que é suficiente para diagnóstico definitivo de EA, dentro do contexto clínico correto (ex: estudos virais de LCR negativos), mesmo na ausência de anticorpos dosados. Todos os outros padrões de ressonância magnética sugestivos de EA (cortical/subcortical, estriatal, diencefálico, tronco encefálico, encefalomielite e meningoencefalite), requerem positivação de anticorpos para diagnóstico definitivo.
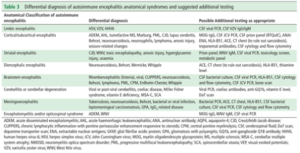
Pacientes com ressonância magnética inicialmente normal, podem mostrar alterações sugestivas de EA na repetição do exame, alguns dias depois. A figura 3 mostra os principais diagnósticos diferenciais para cada uma das síndromes anatômicas de EA.
É importante ressaltar que a ressonância magnética também pode ajudar a excluir diagnósticos alternativos, como acidente vascular cerebral, neoplasia ou doença de Creutzfeldt-Jakob (CJD). Apesar disso, as alterações na ressonância magnética na EA podem imitar outras entidades. A inflamação unilateral e, em menor medida, bilateral, do lobo temporal medial, bem como do córtex orbitofrontal nas sequências FLAIR ou DWI, apóia a encefalite herpética, em detrimento de EA.
- Eletroencefalograma
O eletroencefalograma (EEG) é comumente realizado em pacientes com suspeita de EA para excluir estado epiléptico subclínico em pacientes encefalopatias, ou para monitorar a resposta ao tratamento em pacientes com convulsões. A EA é a principal causa de novo estado epiléptico refratário (NORSE), que pode ser convulsivo ou não convulsivo. O EEG também pode fornecer evidências de anormalidade cerebral focal ou multifocal, quando a ressonância magnética é negativa, o que apoia encefalite autoimune em detrimento de encefalopatia metabólica. Achados sugestivos de EA incluem desaceleração/convulsões focais e descargas periódicas lateralizadas (mais conhecido como Delta Brush, que é ocasionalmente observada na encefalite com anticorpo NMDAR). EEG também pode ajudar a diferenciar EA de CJD.
- Análise do Líquor
Este é o teste mais importante na avaliação de EA e geralmente é a segunda etapa na avaliação, após a ressonância magnética do cérebro. Todos os pacientes com suspeita de encefalite requerem punção lombar (PL), salvo no caso de contra indicações ao procedimento, independente dos achados na RM. Em alguns casos, o LCR de caráter inflamatório pode ser a única anormalidade encontrada, servindo como única indicação para imunoterapia empírica, após a exclusão da infecção. A análise do LCR deve incluir contagem de células com diferencial, proteína, glicose, razão LCR/glicose sérica, quociente de albumina, índice de IgG e taxa de síntese, bandas oligoclonais, estudos virais amplos (incluindo PCR para HSV1/2, PCR para vírus varicela zoster e IgG / IgM, culturas de bactérias/fungos quando apropriado, citologia, citometria de fluxo, e painel de autoanticorpos – NAAs).
Os achados mais comuns na EA incluem: pleocitose linfocítica leve a moderada (comumente 20–200 células, mas pode ser tão alta quanto 900 células), hiperproteinorraquia e, em alguns casos, índice de IgG elevado. Esses achados, no cenário de estudos infecciosos e citologia oncótica negativos, apoiam uma etiologia imunomediada, mas não diferenciam a EA de outras condições imuno-mediadas (por exemplo, neurossarcoidose). Portanto, a correlação clínica é sempre necessária. Em muitos pacientes, o teste com NAAs no LCR e no soro é necessário para aumentar a sensibilidade.
- Exames de sangue
Além de testar NAAs no soro, muitas vezes são necessários vários exames laboratoriais para excluir outros diagnósticos. A seleção do teste pode ser orientada pelo padrão anatômico de ressonância magnética, conforme mostrado na figura 3. Alguns testes podem ser úteis no caso de ressonância magnética negativa, como anticorpos antitireoidianos, painel toxicológico, dosagem de amônia, níveis de vitamina B1/B12, sorologia para HIV, marcadores inflamatórios, anticorpos antinucleares, anticorpos antifosfolípides, anticoagulantes lúpicos, imunoglobulinas e painéis metabólicos/hormonais. O monitoramento do nível de sódio é importante, uma vez que a hiponatremia é comum em certos subtipos de encefalite autoimune (EA), como a encefalite por anticorpo LGI-1.
- Rastreio neoplásico
É quase impossível prever se a EA é paraneoplásica, ou não, com base nos sintomas, pois os dois subtipos de EA apresentam-se de maneira semelhante. Portanto, o rastreamento de neoplasias deve ser considerado na maioria dos pacientes adultos com EA no momento da apresentação.
Confirmar uma etiologia inflamatória autoimune e excluir outras possibilidades
Após a avaliação de anormalidades cerebrais focais ou multifocais por ressonância magnética ou outros estudos, investigações adicionais são indicadas para confirmar EA e excluir outras possibilidades. O teste pode ser orientado pela síndrome clínico-anatômica para restringir o escopo das investigações, conforme mostrado na figura 3 abaixo:
Tratamento agudo
- Necessidade de Unidade de Terapia Intensiva
As principais indicações para admissão de pacientes com EA na unidade de terapia intensiva (UTI) incluem estado epiléptico refratário, disautonomia grave, e comprometimento respiratório (ex: envolvimento do tronco cerebral, síndrome neuromuscular associada ou hipoventilação induzida por medicamento).
O monitoramento cuidadoso e o controle das flutuações da pressão arterial e da frequência cardíaca são essenciais em pacientes com disautonomia grave. Um marcapasso temporário pode ser necessário em alguns pacientes até que a disautonomia melhore. Pacientes com hiponatremia grave podem precisar de correção parcimoniosa para evitar mielinólise pontina central. Na maioria dos casos, a hiponatremia está relacionada à secreção inapropriada do hormônio antidiurético (SIADH).
- Tratamento antimicrobiano empírico
Em muitos pacientes com encefalite, pode ser difícil diferenciar as etiologias infecciosas das autoimunes antes da análise do LCR e, portanto, o início de antimicrobianos empíricos com cobertura do SNC é sempre recomendado até que a possibilidade de infecção seja excluída. A prática comum é iniciar aciclovir intravenoso e cobertura padrão para meningite bacteriana. A antibioticoterapia e o aciclovir podem ser descontinuados posteriormente se os estudos bacterianos do LCR e do HSV/VZV forem negativos.
- Imunoterapia aguda
Vários estudos retrospectivos mostraram que a imunoterapia precoce e agressiva está associada a melhores resultados em pacientes com EA. Os critérios clínicos de EA de 2016 enfatizam a importância de iniciar imunoterapia quando a suspeita de EA é alta e as etiologias infecciosas foram excluídas com base nos resultados do LCR (contagem de células, glicose, PCR viral, coloração de Gram). É impraticável e potencialmente perigoso atrasar a imunoterapia até que a EA seja confirmada por dosagem de anticorpos positivos. Não existem ensaios clínicos robustos comparando as diferentes modalidades de imunoterapia. Portanto, a escolha da terapia inicial é baseada na apresentação sindrômica específica e comorbidades.
Terapias de Primeira Linha
- Corticosteróides em altas doses
O tratamento empírico com metilprednisolona intravenosa (1g/dia durante 3-7 dias) é uma abordagem razoável para atingir o efeito imunossupressor e anti-inflamatório inicial em pacientes com EA. É também a abordagem preferida em apresentações conhecidas por serem especialmente responsivas a corticosteróides. São elas: padrão desmielinizante na ressonância magnética (sugestivo de sobreposição de EA com síndromes desmielinizantes), ou realce pontilhado sugestivo de CLIPPERS, por exemplo. Pacientes com FBDS sugestivo de encefalite por anticorpo LGI1 também podem mostrar uma resposta dramática aos corticosteróides. Já as condições paraneoplásicas associadas aos anticorpos onconeuronais clássicos costumam ser resistentes à imunossupressão e tendem a responder melhor à terapia do câncer. Mesmo assim, recomenda-se também tentar a pulsoterapia com metilprednisolona, que é o agente de escolha para as encefalites paraneoplásicas até o momento.
Uma desvantagem teórica dos corticosteróides em EA é seu risco potencial de causar sintomas comportamentais/psiquiátricos, dificultando uma avaliação oportuna da resposta ao tratamento. No entanto, na maioria dos casos, os corticosteróides podem melhorar esses sintomas. Em pacientes com lesões atípicas, ou semelhantes a massa, na ressonância magnética cerebral, o linfoma primário do SNC está no diagnóstico diferencial. Nesta situação, os corticosteróides devem ser adiados para não interferir nos resultados da patologia, se uma biópsia for considerada durante a hospitalização.
- Imunoglobulina intravenosa
A Ig intravenosa (IVIg) é usada na dose de 2 g/kg durante 2–5 dias. Ela é uma opção para imunomodulação rápida quando os corticosteróides são contraindicados ou quando o quadro clínico é sugestivo de doença mediada por anticorpos (por exemplo, encefalite por anticorpo NMDAR) . A IVIg é mais prontamente disponível do que a plasmaférese (PLEX) em alguns centros e não requer um cateter venoso central para realização.
Uma desvantagem da IVIg é sua associação com aumento do risco tromboembólico. Portanto, a IVIg deve ser usada com cautela em pacientes com encefalites autoimunes paraneoplásica ou na presença de fatores de risco para trombose (por exemplo, tabagismo e idosos). Além disso, acredita-se que a etiologia da EA paraneoplásica seja mediada por células, ao invés de anticorpos, tornando o uso de IVIg neste cenário potencialmente ineficaz. O uso de IVIg também pode piorar a hiponatremia coexistente devido à expansão de volume, predispondo a edema cerebral e piora do estado mental.
- Plasmaférese
A PLEX (5–10 sessões em dias alternados) é uma opção eficaz para imunomodulação aguda, quando os corticosteróides são contraindicados ou ineficazes. Ela fornece uma imunomodulação mais rápida em pacientes com apresentações graves ou fulminantes. Não tem efeitos colaterais psiquiátricos conhecidos e não aumenta o risco de tromboembolismo, exceto para trombose relacionada ao sistema. As principais limitações incluem aumento do risco de sangramento, mudanças de volume (que podem ser problemáticas em pacientes disautonômicos), e necessidade de colocação de cateter venoso central.
- Terapias combinadas de primeira linha
Se o quadro clínico inicial for grave (por exemplo, encefalite com anticorpo NMDAR, NORSE, disautonomia grave), podemos considerar o uso de terapias de primeira linha combinadas desde o início (apesar da falta de evidências de alta qualidade para apoiar essa prática). Comumente, a terapia combinada é feita sequencialmente, se não houver resposta significativa ao agente inicial (por exemplo, iniciar IVIg e/ou PLEX após completar os corticosteróides).
- Agentes de segunda linha
Se não houver resposta clínica ou radiológica significativa com terapia de primeira linha otimizada após 2-4 semanas, a adição de um agente de segunda linha pode melhorar o resultado. No entanto, a definição exata e o tempo para avaliação de resposta ao tratamento não estão bem definidos. Tanto o rituximabe quanto a ciclofosfamida têm sido usados como agentes de segunda linha para terapia de resgate na encefalites autoimunes com bons resultados. O Rituximabe é menos tóxico do que a ciclofosfamida, sendo considerado o agente de escolha. No entanto, ele pode ser menos eficaz para inflamações mediadas por células, como no caso dos auto anticorpos contra antígenos intracelulares.
Na maioria dos casos, é difícil determinar clinicamente se a AE é mediada por anticorpos ou células, antes do resultado da dosagem de anticorpos. Algumas pistas podem ajudar o clínico a chegar a uma hipótese preliminar em relação à etiologia (por exemplo, fasciobraquio distonias na encefalite por anticorpo NMDAR ou neoplasia ativa na EA mediada por células). Com base nessas pistas, podemos optar pelo uso de rituximabe ou ciclofosfamida como um agente de segunda linha. A posologia usual do rituximabe é a realização de duas doses de 1000 mg, com duas semanas de intervalo entre elas.
Conclusão
A descoberta de uma série de novos autoanticorpos responsáveis pelo desenvolvimento de encefalites autoimunes têm permitido estimar sua prevalência (talvez tão comum quanto encefalites virais), proporcionar uma abordagem diagnóstica de acordo com síndromes clínicas anatômicas, e realizar diagnóstico diferencial com causas não imunes. Neste texto, são citadas as práticas terapêuticas mais recomendadas para o manejo agudo das encefalites autoimunes. Para acessar o artigo na íntegra, segue a referência abaixo.
Referências bibliográficas:
- Abboud H, Probasco JC, Irani S, Ances B, Benavides DR, Bradshaw M, Christo PP, Dale RC, Fernandez-Fournier M, Flanagan EP, Gadoth A, George P, Grebenciucova E, Jammoul A, Lee ST, Li Y, Matiello M, Morse AM, Rae-Grant A, Rojas G, Rossman I, Schmitt S, Venkatesan A, Vernino S, Pittock SJ, Titulaer MJ; Autoimmune Encephalitis Alliance Clinicians Network. Autoimmune encephalitis: proposed best practice recommendations for diagnosis and acute management. J Neurol Neurosurg Psychiatry. 2021 Jul;92(7):757-768. doi: 10.1136/jnnp-2020-325300
Autoria

Chadi Emil Adamo
Colunista de Neurologia do Portal PEBMED ⦁ Neurologista pelo Hospital das Clínicas da FMRP - Universidade de São Paulo ⦁ www.drchadineurologista.com
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.

