A super aguardada sessão plenária do 30º Congresso da Sociedade Europeia de Hematologia finalmente começou no dia 14 de junho de 2025 e com ela a também aguardada apresentação do estudo de fase 1 que trazia, pela primeira vez, o uso em humanos do anticorpo triespecífico JNJ-79635322.

O JNJ-79635322, seus objetivos e as questões por trás da novidade
Esse anticorpo objetiva alcançar os alvos GPRC5D e BCMA simultaneamente, antes contemplados de forma individual pelos biespecíficos talquetamab e teclistamab, respectivamente. O responsável pela apresentação dos dados deste estudo foi o Dr. Rakesh Popat da University College London, em Londres.
Antes mesmo de a apresentação começar, a plateia já borbulhava com questões como:
- A eficácia das duas drogas se somará nessa única molécula?
- O custo desse aumento de eficácia seria também a soma dos efeitos adversos de ambas as medicações?
- A síndrome de liberação de citocinas seria potencializada com a presença de dois alvos no plasmócito e, portanto, maior alcance da droga?
- E, por último, seria melhor utilizar essa droga em relação a cada uma delas isoladamente em termos de eficácia e duração de resposta?
Já vou adiantando que essa terceira pergunta nós não podemos responder ainda, pois trata-se de um estudo fase 1. O objetivo principal do estudo era avaliar toxicidade e doses limitantes para essa droga, e, em havendo resultados positivos, a ideia é justamente prosseguir para estudos de fase 2 e 3 que avaliem com mais minúcia a eficácia e o seguimento de longo prazo.
O Dr. Popat inicia sua palestra, naturalmente, citando o estudo LocoMMotion que já é bem conhecido de todos nós e que mostra que pacientes com mieloma múltiplo, refratário ou recaído, após a exposição a três classes de droga, sendo elas um anti-CD38, um imunomodulador e um inibidor de proteassoma, têm uma sobrevida livre de progressão mediana de 4.6 meses. Foi nesse contexto que os anticorpos biespecíficos surgiram.
Especificamente falando sobre associação de biespecíficos, Dr. Popat lembrou a plateia de que isso não é totalmente novo no ramo: o estudo Redirect-TT (que também foi apresentado nesse Congresso) já tinha associado, individualmente, talquetamabe e teclistamabe, mostrando taxas de resposta global animadoras em torno de 80%, mesmo em populações de maior risco como aquelas enriquecidas em doença extramedular.
Partindo para o racional biológico, o autor mostrou a estrutura da molécula e o racional de sua ação. A JNJ-79635322 tem uma ligação ao CD3 linfocitário, ao BCMA e ao GPRC5D plasmocitários, conforme se vê na figura abaixo:
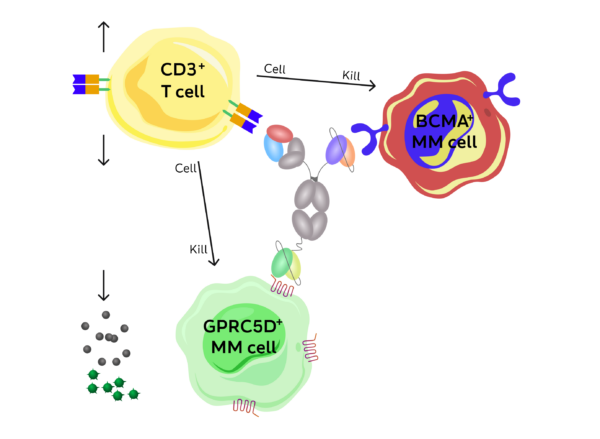
O autor frisou uma importante característica biológica da molécula e que tem papel crucial em seus efeitos: a afinidade do receptor de CD3 é baixa, o que faz com que a ligação do linfócito T a essa molécula seja algo transitório, porém eficaz. O racional biológico disso seria evitar a exaustão desse linfócito e evitar os efeitos deletérios de uma forte ligação linfócito-plasmócito, como, por exemplo, estimulação pró-inflamatória prolongada culminando em uma pior síndrome de liberação de citocinas.
Na descrição do desenho do estudo, o autor mostrou que diversos regimes de escalonamento de dose foram testados a fim de se encontrar a dose recomendada para um estudo de fase 2. Não vou detalhar aqui quais foram esses regimes, mas o importante é saber que ao final de todos esses testes, os autores chegaram a uma dose inicial de 5mg, escalonando rapidamente para 100mg. Essa dose final seria aplicada subcutânea uma vez por mês (lembre que no Redirect-TT, a associação talquetamabe + teclistamabe era aplicada a cada duas semanas!).
Neste momento, o autor também pontua que o escalonamento de dose é muito breve, de 5mg a 100mg, o que não é muito comum se tratando de biespecificos, onde o mais comum é expormos o paciente a 3 doses intermediárias antes da dose final. Vamos aos resultados!
Resultados com o anticorpo JNJ-79635322
Dos 126 paciente tratados, 36 receberam a dose recomendada para fase 2 (100mg Q4W). Em um seguimento mediano de 8.2 meses e mediana de 4 linhas prévias de tratamento, esses pacientes tinham mediana de idade de 64 anos, 100% deles eram triplo expostos, 31% tinham citogenética de alto risco e 77% eram virgens de qualquer tratamento envolvendo anti-BCMA ou anti-GPRC5D.
Quando aos efeitos adversos, tivemos:
| Evento Adverso (AE) | Incidência | Grau 3/4 |
| Síndrome de liberação de citocinas (CRS) | 59% (G1: 45%; G2: 14%) | 0% |
| Alterações ungueais | 56% (G1/2) | 0% |
| Alterações de paladar | 56% (G1/2) | 0% |
| Neutropenia | 48% | 41% |
| Toxicidades cutâneas não-rash | 47% | 1% |
| Perda de peso | 16% | 0% |
| Rash | 16% | 0% |
| ICANS | 2% (todos G1) | 0% |
| Infecções | 75% | 28% |
| Toxicidades limitantes de dose (DLT) | 5 pacientes | – |
| Óbitos relacionados a AE | 4 pacientes | – |
Algumas observações importantes
- Nenhum evento de síndrome de liberação de citocinas grau 3 ou mais foi reportado!
- Disgeusia foi reportado em 56% dos pacientes (bem abaixo dos 72.3% reportados em bula do talquetamabe.
- Infecções de qualquer grau ocorreram em 75% dos pacientes (próximos aos 80% que encontramos com uso de teclistamabe), mas apenas 28% grau 3 ou mais (ou seja, necessitando de internação hospitalar, uso de antimicrobianos endovenosos, etc).
As taxas de resposta, apesar de não serem o objetivo principal do estudo, também foram animadoras!
Eficácia (pacientes avaliáveis para resposta)
| População | ORR | ≥VGPR | mFU |
| Todos os pacientes (n = 124) | 73% | 66% | – |
| RP2D (100 mg Q4W; n = 36) | 86% | 75% | – |
| RP2D + naïve a anti-BCMA/GPRC5D (n = 27) | 100% | 89% | 8,5 meses |
| Tempo mediano até a primeira resposta | 1,2 meses | – | – |
O autor concluiu sua apresentação trazendo a perspectiva de expansão do estudo e novas fases subsequentes dele, já que o perfil de toxicidades foi previsível e manejável, e a eficácia da droga é inquestionável!
As perguntas da plateia focaram predominantemente nos efeitos adversos e na explicação biológica para a menor incidência deles. Ainda durante as perguntas, o autor teve a oportunidade de ressaltar o interesse particular do uso dessa droga naqueles pacientes cujo mieloma, como mecanismo de escape imunológico, faz downregulation do BCMA ou do GPRC5D.
E como isso muda nossa prática?
- Talquetamabe e teclistamabe já são aprovados pela ANVISA desde março de 2023 e março de 2024, respectivamente. Os dados do Monumental-1 e Majestec-1 estão maduros e o perfil de toxicidade das drogas é cada vez melhor elucidado. São alvos que conhecemos e efeitos previsíveis.
- O advento de um anticorpo triespecífico uniria eficácia terapêutica em uma droga off the shelf (prontamente disponível), que não incluiria os trâmites e os processos que uma terapia com CAR-T cell demanda, e com perfil de toxicidades melhor tolerável e posologia mais cômoda (1x por mês).
- Podem ter certeza de que essa não será a última vez que vocês ouvirão falar de anticorpos triespecíficos
Autoria

Luiza Lapolla Perruso
Como você avalia este conteúdo?
Sua opinião ajudará outros médicos a encontrar conteúdos mais relevantes.

